Nuevamente les dejo la monografía de una de mis alumnas de este año sobre una patología hereditaria en caninos:
Paladar hendido y labio leporino en Caninos
Monografía de Genética
Universidad Nacional de Rio Negro
Profesora: Iglesias,Gabriela
Autora
Aciar, María Belén
Introducción:
El paladar hendido se caracteriza porque existe una comunicación anormal entre las cavidades oral y nasal que afecta a paladar blando, duro, hueso pre maxilar y labio.
Se clasifica en paladar hendido primario y secundario y ambos están en íntima relación pues tienen el mismo origen embrionario.
Desarrollo:
El paladar se divide en paladar duro y paladar blando. El primero es la estructura formada por huesos incisivo, maxilar y por mucosa nasal y bucal que separa la cavidad nasal de la bucal.
Mientras que el paladar blando es la continuación caudal que divide la nasofaringe de la oro faringe y no presenta estructuras óseas .
En pequeños animales las alteraciones más frecuentes del paladar son: paladar hendido (que puede afectar tanto el paladar duro como blando) y paladar elongado (que solo afecta al paladar blando)
El paladar hendido es una comunicación anormal entre las cavidades bucal y nasal que implican el paladar blando, paladar duro, pre maxilar y labio .
El paladar primario lo constituyen el labio y el pre maxilar, si cierre incompleto es lo que se llama hendidura primaria o labio partido (Labio leporino).
Mientras que el paladar secundario lo constituye el paladar duro, paladar blando; y el cierre incompleto de cualquiera de estas dos se denomina hendidura secundaria o paladar hendido.[1]

http://www.uco.es/organiza/departamentos/anatomia-y-anat-patologica/peques/curso08_09/paladar1.pdf
Los defectos se producen cuando las dos capas palatinas no logran fusionarse totalmente durante el desarrollo fetal ocurriendo aproximadamente entre los 25 o 28 días de la gestación en los perros.
El riesgo grave de esta malformación reside en la dificultad que tienen las crías para su alimentación, ya que les es imposible succionar siéndole imposible realizar dicha acción ,generando que muchos animales mueran a los pocos días de nacer o bien son sacrificados.
Las complicaciones de esta alteración son, fundamentalmente, problemas de naturaleza respiratoria como rinitis irritativas crónicas, faringitis, laringitis, otitis medias con síndrome vestibular periférico y neumonías por aspiración, que pueden llegar a ser mortales.
Estos defectos se han observado sobre todo en razas braquicéfalos con una incidencia mayor en razas puras que mestizas, entre estas razas las de mayor riesgo son:
Terrier de Boston, Pekines, Bulldog, Schnauzer miniatura, Beagle, Cockerspaniel.[2]

Paladar hendido en cachorro dehttp://www.diagnosticoveterinario.com/paladar-hendido/782
Razas susceptibles:
En los seres humanos y los perros, el labio leporino y paladar hendido ocurren naturalmente con diferentes grados de gravedad, y puede ser causada por varios factores genéticos y ambientales (carencias de minerales, de vitamina A, exposición de la madre a rayos X, tóxicas, corticoides, influencias hormonales y causas mecánicas). Con el fin de comprender mejor el paladar hendido en ser humanos se ha llevado a cabo varios estudios y trabajo de investigación con el mejor amigo del hombre “el perro” siendo un modelo único para ayudar a comprender las bases genéticas de origen natural.[4]

Distintas razas afectadas
Estudios realizados
Con el fin de estudiar el paladar hendido en un sistema de modelo natural se utilizó el Retriver de Nueva Escocia (NSDTR)
DLX es una familia homeodominio.
Estos genes DLX en vertebrados se expresan principalmente a nivel craneofacial, involucrado en el desarrollo del cerebro y extremidades del cuerpo, incluyendo Cresta Ectodérmica Apical. Los miembros conocidos de la familia incluyen desde DLX1 hasta DLX6.
DLX5 y DLX6 se seleccionaron para la secuenciación, estos genes codifican un miembro de un homeobox (secuencia de AN que se encuentran involucrados en la regulación de los patrones de desarrollo anatómico) siendo una familia de genes de factor de transcripción.
DLX5 y DLX6 se pueden ver para trabajar en conjunto y son esencialmente necesarias para el correcto desarrollo craneofacial, axial, y el esqueleto apendicular, cuando se produce la inactivación selectiva de dichos genes pueden conducir a tener una gran probabilidad de letalidad perinatal.[6]
En el siguiente gráfico veremos lo dicho anteriormente: (IMAGEN 7)
Esta imagen demuestra un Pedigree de 7 familias de NSDTR que representan la segregación del alelo mutante con la LINE-1 elemento de inserción. Los símbolos llenos representan NSDTRs con el fenotipo CP1. Las líneas diagonales indican que el NSDTR ha fallecido. «+» Representa el alelo de tipo salvaje. «M» representa el alelo mutante.[7]
El análisis de segregación y alelo de frecuencia, se llevó a cabo en el gen DLX6 Line-1 indicando que dicha inserción segrega tanto con el fenotipo y con modo de herencia autosómico recesivo. En dicha imagen también podemos observar que en cada familia del pedigree hay cierta probabilidad de letalidad.[7]
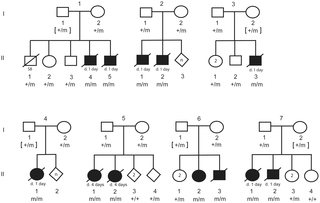
Pedigree analizado de https://journals.plos.org/plosgenetics/article?id=10.1371/journal.pgen.1004257
También se realizó un PCR de amplificación y análisis de la inserción LINEA en el CP1 y NSDTR.
Se realizó en DNA a partir de la corteza cerebral, tanto para DLX5 y DLX6. DLX5 y DLX6 fueron secuenciados en un neonatal NSDTRCP1 con la inserción LINE- 1 y se compararon con un solo neonatal NSDTR de control no afectado.
No se identificaron polimorfismos dentro de DLX5
.El ADNc a partir del CP1 NSDTR mostró tanto la transcripción DLX6 de tipo salvaje y una transcripción más grande que contenía 1281 pares de bases de la intrónica LINE- 1 de inserción.[7]
El análisis de secuencia y la traducción de los aproximadamente 1,2 kilobases LINE- 1 de inserción predicen un codón de stop después de la inserción de un nuevo exón.[7]
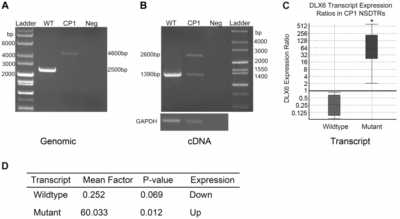
PCR realizada de https://journals.plos.org/plosgenetics/article/figure/image?size=medium&id=10.1371/journal.pgen.1004257.g003
Esquema de la estructura del gen genómico y DNA del DLX6 no afectado y (CP1) NSDTR afectado. La región de la conservación representada en rojo es la región interrumpido por la inserción LINE- 1. [7]
Materiales y métodos:
Muestras caninas y extracción de ADN
Se extrajeron muestras de sangre y tejidos de NSDTRs con paladar hendido (n = 14), hermanos de camada sanos ( n = 24) , padres (n = 11), NSDTRs no afectadas (n = 153 ).
El tejido se recogió en el examen post mortem y flash congelado . Las evaluaciones de las hendiduras orofaciales se realizaron por inspección visual de los perros afectados.[8]
Imagen Computarizada
Tomografía computarizada micro-de alta resolución (micro-CT) se utilizó para evaluar las estructuras craneofaciales en 4 NSDTRs CP1 que eran homocigotos para la inserción LINE-1, y en 3 NSDTRs normales homocigóticos para el alelo de tipo salvaje.
Tomografía computarizada micro-de alta resolución (micro-CT) se utilizó para evaluar las estructuras craneofaciales en 4 NSDTRs CP1 que eran homocigotos para la inserción LINE-1, y en 3 NSDTRs normales homocigóticos para el alelo de tipo salvaje. [8] ver Página de Técnicas de Biología molecularhttps://gen-molecular.org/tecnicas-de-biologia-molecular
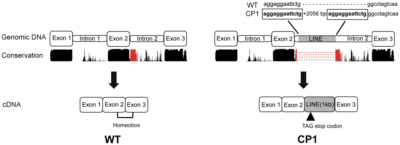
ADN genómico del ADN copia de https://journals.plos.org/plosgenetics/article/figure/image?size=medium&id=10.1371/journal.pgen.1004257.g004
Conclusión
En resumen, la identificación de una mutación en un modelo de animal siendo el perro presentando defectos congénitos de origen natural ha permitido la identificación de nuevos genes en las personas, ayudando a comprender e informarnos más sobre este tema.
En relación a los animales es un estudio muy complejo llevando a cabo diferentes métodos de investigación, cumpliendo ampliamente con el objetivo de informar, presentar y llevar a cabo datos relevantes e informativos sobre este caso viéndose en mayor frecuencia en aquellos perros de razas con características braquicéfalos.
Referencias bibliográficas
1 Elena Galan Diaz, Anahí Ortiz Ruiz. Anatomía aplicada de los pequeños animales: Alteraciones en el paladar. Pag:2
[2]Jesús Fernández Sánchez;Fidel San Román Ascaso;Nicolás Israeliantz Gunz;Alejandra Galiñanes Plaza;Marta Pedraja Marqués; María de la Morena Cabanillas. Patología de la cavidad oral: Tratamiento quirúrgico del paladar hendido secundario congénito en perro. Pag: 2
[3]Terry Brown. (2008).Genome (3ra edición ).Editorial Medica Panamericana.
[4] Tratamiento quirúrgico del paladar hendido secundario congénito en perro. Hospital Clínico Veterinario Dr Jesús Mª Fernández Sánchez Facultad de Veterinaria. UCM. Madrid.
[5] Panganiban, G .; Rubenstein, JL (2002). «Funciones del Desarrollo de los genes homeobox distal-less / Dlx» Development (Cambridge, Inglaterra) 129 (19):.. Desde 4.371 hasta 4.386 PMID 12223397.
[6] «Entrez Gene: DLX5 distal-less homeobox 5».
[7] Wolf ZT, Leslie EJ, Arzi B, Jayashankar K, Karmi N, Jia Z, et al. Published: April 3, 2014. A LINE-1 Insertion in DLX6 Is Responsible for Cleft Palate and Mandibular Abnormalities in a Canine Model of Pierre Robin Sequence. PLoS Genet 10(4): e1004257. doi:10.1371/journal.pgen.1004257
[8]- Purcell S, Neale B, Todd-Brown K, Thomas L, Ferreira MA, et al. (2007) PLINK: a tool set for whole-genome association and population-based linkage analyses. Am J Hum Genet 81: 559–575
Espero les haya gustado y les sirva a muchos otros en el camino de aprender
Saludos
Gaby

