En esta ocasión les dejo la monografìa realizada por la alumna Betiana Tscherig acerca de la Parálisis Periódica Hiperkalémica (HYPP) en equinos y su forma de diagnóstico por técnicas de biología molecular. Espero les sirva a todos aquellos en el camino de aprender y los interesados en aprender sobre el tema.
Saludos
Gaby

Escuela de Medicina Veterinaria y Producción agroindustrial.
Parálisis periódica hipercalémica (HYPP) en equinos.
Con la presente monografía se darán a conocer con detalles, aspectos propios de la Parálisis Periódica Hipercalémica (HYPP) haciendo especial hincapié en el área genética.
Se trata de una enfermedad genética de tipo autosómica dominante presente en los equinos que básicamente afecta los canales de sodio en las células del músculo y la capacidad para regular los niveles de potasio en la sangre.
Esta enfermedad presenta una amplia variedad de síntomas clínicos y se generalizó cuando los criadores trataron de producir caballos con musculatura pesada. Hipótesis que posteriormente se descartó.
Se debe tener presente que dicha afección no solo se produce en equinos sino que también lo hace en los seres humanos, en los cuales se denomina Gamstorp adynamy episódica.
Características propias de la Parálisis Periódica Hipercalémica.
Herencia.
La Parálisis Periódica Hipercalémica es una enfermedad muscular que se presenta en los descendientes del semental Cuarto de Milla «Impressive» (AQHA 767246), oriundo Oklahoma, Estados Unidos.
El semen de este equino fue seleccionado y utilizado de manera intensa gracias a las cualidades de conformación de dicho semental, desconociendo aún la mutación.
Tal es así que a partir del año 2003 se registraron más de 55.000 equinos vivos relacionados en su genealogía con Imprenssive (según registros de la AQHA), pero se sabe que contribuyó a la composición genética de 2.9 millones de caballos registrados (Rudolph et al., 1992).
En la actualidad se dice que la Parálisis Periódica Hipercalémia equina se presenta en 1 de cada 50 caballos cuarto de milla.
También se ha reportado su presencia en varias líneas de caballos tales como Apaloosa y Pintos (Church 1995, Rudolph et a/, 1992).
En 1996, el Dr. Naylor sugirió como hipótesis que las anomalías en la transmisión del potencial de membrana de los caballos HYPP-positivo podrían conducir a la hipertrofia muscular característica en esta línea.
Doctores expertos de la Universidad de California Davis y de la Universidad de Valberg, Minnesota, llevaron a cabo los análisis musculares para apoyar o refutar esta hipótesis mediante biopsias del músculo glúteo pero no encontraron ninguna diferencia en cuanto al porcentaje de contracción, edades o tamaño de las fibras y ninguna asociación con la gravedad clínica. Por lo tanto, su investigación descartó la hipótesis del Dr. Naylor.
Características genéticas.
La parálisis periódica hipercaliémica (HYPP) es una enfermedad genética de herencia autosómica dominante, es decir que es requerida una sola copia del gen (alelo) para que se presente la enfermedad.
Durante un estudio genético llevado a cabo en Stichting Klinisch Genetisch Centrum de Leiden (Holanda) en humanos se determinó que la enfermedad está causada por mutaciones en el gen SCN4A, que codifica la subunidad alfa (α) del canal de sodio muscular o canal de tipo IV.
Se trata de una proteína transmembrana de 1.836 aminoácidos que, junto a la subunidad beta (β) del canal, media la permeabilidad de las membranas musculares excitables a los iones de sodio.
El canal adopta conformaciones abiertas o cerradas en función de las diferencias de voltaje y el sodio pasa a través del poro de acuerdo con su gradiente electroquímico.
El gen, que tiene 24 exones y se localiza en el cromosoma 17q23.3, fue identificado como la causa de la enfermedad mediante cartografía genética y análisis mutacional. (B. Narberhaus; 2008)
Normalmente para evitar que el músculo se contraiga continuamente, el canal de sodio se cierra mediante su compuerta de inactivación rápidamente después de que se abra y tome contacto con el ion.
Con el tiempo, los iones de potasio salen de las células musculares, repolarizando así a las células y provocando el bombeo de calcio fuera del aparato contráctil para relajar el músculo. (Ganong, 2010)
Mediante el estudio génico de Narberhaus y otros investigadores, se determinó además que se presenta un cambio en heterocigosis, una transición nucleotídica de Citocina a Timina en el exón 13 del gen, que resulta en una sustitución aminoacídica de treonina (Thr) a metionina (Met) en el residuo 704 de la proteína (c.2111C>T, p.Thr704Met).
En cambio, en el equino esta mutación de punto consiste en una sustitución de Citosina a Guanina en el gen que codifica el dominio transmembranal de la sub-unidad alfa del canal de sodio muscular.
El intercambio de citosina por guanina de la proteína SCN4A resulta en la sustitución de un residuo fenilalanina por leucina el cual es más pequeño que el residuo de la fenilalanina, resultando fisiológicamente o electroquímicamente en la fuga del ion sodio, a través del poro de la membrana celular que debería permanecer cerrado cuando no está bajo estimulación nerviosa (que generaría una contracción muscular) (Reynolds, 1997).
La mutación en esta especie fue aislada en 1994 por investigadores de la Universidad de Pittsburgh, con una subvención de diversas organizaciones de equinos; los mismos desarrollaron un análisis de sangre el cual es utilizado actualmente para la identificación de los individuos afectados.
Las mutaciones, alteran la estructura normal y la función del canal de sodio e interrumpen de este modo la regulación de la contracción muscular, originando así cierta susceptibilidad a los episodios de parálisis del mismo.
“La sustitución aminoacídica impide la inactivación del canal que sigue normalmente a un potencial de acción, dando lugar a un flujo incontrolado de sodio hacia el interior de la fibra muscular. Como consecuencia, la fibra se despolariza activando la entrada de calcio desde el retículo sarcoplasmatico para causar la contracción del músculo, impidiendo la generación de nuevos potenciales de acción. La entrada masiva de sodio dentro de las células provoca una salida de potasio que explica los niveles aumentados de este catión en sangre que son característicos de la enfermedad.” (B. Narberhaus; 2008)
El fallo de los canales de sodio para inactivar correctamente se ve favorecido frente a factores como el estrés o cuando los niveles de potasio en la sangre fluctúan. Esto último puede ocurrir con el ayuno seguido por el consumo de un alimento rico en potasio, como la alfalfa. (ucdavis.edu., 2015)
Descendencia.
Desde el año 1998, la AQHA (American Quarter Horse) exige revelar la condición genotípica de la HYPP en los documentos de registro de todos los potros que descienden de alguna línea genética identificada como portadora del gen portador.
Si un potro y sus progenitores no han sido analizados para el gen HYPP, los documentos de registro deberán llevar la leyenda: “Este caballo tiene un ancestro conocido como portador del gen HYPP, designado de a cuerdo a las reglas de la AQHA como un defecto genético.
La AQHA recomienda realizar el examen respectivo para confirmar la presencia o ausencia de este gen” (Crabbe, 1998).
Según los resultados de los análisis realizados a los equinos para el gen HYPP el documento de registro del animal llevará la designación “N/N”, “N/H” o “H/H”. (Ayala, M., 2005)
Homocigota recesivo: N/N. resulta negativo para la enfermedad, lo cual significa que no es portador del gen HYPP y por ende no lo transmiten, aunque sean descendientes de Impressive.
Heterocigota: N/H. si tiene una copia o alelo del gen el caballo resulta positivo a la mutación. Estos caballos se ven afectados en un grado menor.
Homocigota dominante: H/H. Si tiene dos alelos del gen. Darán lugar a toda la descendencia que lleva el gen defectuoso, independientemente del estado del otro progenitor. El fenotipo se muestra como severamente afectado.
Se concluye con esto que los animales homocigótos para la mutación (H/H) son severamente más afectados que los heterocigótos (N/H) (Beech et al., 1993) y por esto se deben de tener en cuenta las siguientes posibilidades de apareamiento:
- Un equino (♂ o ♀) heterocigótico para la mutación (N/H), tiene un 50% de probabilidad de transmitir una copia del gen anormal (H) a su descendencia cuando es apareado con un equino normal (N/N) mientras que el otro 50% lleva la mutación (N/H).
- Un equino (♂ o ♀) heterocigótico para la mutación (N/H), tiene un 75% de probabilidad de procrear un potro con HYPP (50% N/H; 25% H/H), cuando es apareado con otro equino también heterocigótico (N/H)
- Un equino (♂ o ♀) homocigótico para la mutación (H/H), tiene un 100% de probabilidad de procrear un potro con HYPP (100% N/H), cuando es apareado con un equino normal (N/N). . (Ayala, M., 2005)
De esta forma, sólo cruzando animales sanos (N/N), previamente detectados por diagnóstico molecular de Parálisis Periódica Hipercalémica, podría reducirse la incidencia de la mutación y eventualmente eliminarse (Naylor, et al. 1999, Spier, et al. 1990), a la vez que se conservan los rasgos deseables de la línea del semental Impressive. (Spier, 1993).
Sintomatología.
Los síntomas principales de la enfermedad en el animal son la rigidez, tremor (hiperexcitabilidad) o debilidad muscular, prolapso del tercer párpado, relincho anormal (por afección de los músculos de la laringe) y convulsiones en ocasiones acompañadas de parálisis de músculos respiratorios y cardiacos que pueden derivar en la muerte por falla cardiaca o respiratoria (Bowling et al., 1996).
Estos síntomas se manifiestan principalmente en la etapa adulta de los animales afectados, pero pueden aparecer algunos de ellos entre los dos a tres años de edad dependiendo de la influencia que tienen las prácticas de manejo como el transporte y la alimentación que estimulan dicha alteración (dado que puede ser agravada por incremento de potasio o frío). Factores como la edad, el género, y la cantidad de músculo no son importantes para la predicción de síntomas HYPP.
La HYPP en ocasiones es confundida con el síndrome de cólico ya que los animales afectados normalmente caen por la debilidad muscular, presentando similar incoordinación de las extremidades y los sonidos respiratorios.
Pero a diferencia del cólico, la duración de una convulsión es muy rápida y el caballo está totalmente normal después de la recuperación. (ucdavis.edu, 2010)
El ataque convulsivo se produce cuando el potasio sale de la célula al torrente sanguíneo y la célula se llena de sodio produciendo una alteración en la conducción eléctrica hacia los músculos, esto surge como mecanismo compensatorio fisiológico para tratar de evitar el acumulo excesivo de cargas positivas en el interior de la célula. Los equinos son plenamente conscientes y lúcidos durante un ataque. (ucdavis.edu, 2010)
Así mismo, se han reportado manifestaciones subclínicas de animales afectados. (Citado por Moreno Chapa, J. 2007)
Diagnostico de la enfermedad
Una forma de llegar al diagnóstico de la enfermedad es analizando una muestra de sangre conservada en citrato sódico tomada durante uno de los ataques, para confirmar la hipercalemia, ya que en ese momento siempre se manifiesta un repentino incremento en la concentración de potasio en suero (por arriba de 8 a 9 mEq/L). Tal aumento indica que se ha alterado la entrada y salida convencional del electrolito. (Wikipedia, 2014)
El genotipo de los individuos también puede determinarse mediante una Prueba de Reacción en Cadena de Polimerasa y Polimorfismo de Longitud en Fragmentos de Digestión (PCR-RFLP), que consiste en una amplificación in vitro de un fragmento específico del gen (Ácido DesoxirriboNucléico -ADN) del canal de sodio seguida de una separación electroforética de los productos de PCR digeridos por la enzima de restricción Taq I de los productos amplificados (Rudolph et al., 1992).
De esta forma, para distinguir entre un individuo que presenta una mutación y otro que no, se elige la enzima de restricción que reconozca su sitio de corte (en un genotipo u otro), de forma que el corte se efectúe sólo en los individuos de un genotipo determinado.
Posteriormente se visualizara este polimorfismo de longitud de fragmento de restricción (RFLP) del ADN amplificado a través de un corrimiento electroforético en gel de agarosa (Rudolph et al. 1992) mostrando en una o dos bandas los productos de PCR digeridos (Griffiths et al 1995, Puertas 1999). Esta técnica muestra una precisión de 99% (citado por Moreno, J. 2007 desde Bowling et al. 1996).
El fragmento del gen donde se da la mutación a través de la amplificación originada por la enzima termoestable Taq polimerasa, proveniente de una bacteria (Thermus aquaticus), efectúa el proceso de polimerización de una cadena complementaria de ADN, obteniéndose millones de copias del fragmento de interés. (citado por Moreno, J.)
“La enzima de restricción Taq I lo corta si no existe la mutación, originando dos fragmentos, mientras que si la hay sólo se genera un fragmento para encontrar la mutación dentro del gen específico.
Esto consiste en una amplificación de un fragmento específico del gen del canal de sodio, el cual es después digerido con una endonucleasa (enzima de restricción Taq l) que lo corta si no existe la mutación, originando dos fragmentos, mientras que si la hay solo se genera un fragmento” (Rudolph et al. 1992).
Los iniciadores o primers a utilizar permiten la amplificación, por la técnica de Reacción en Cadena de la Polimerasa, de la secuencia correspondiente al segmento del gen donde ocurre la mutación, específicamente en la base nitrogenada 2188 de su ADNc.
Los iniciadores de PCR son los siguientes (Rudolph et al. 1992):
IVS2F: 5′-GGGGAGTGTGTGCTCAAGATG-3′
IVS3R: 5′-AATGGACAGGATGACAACCAC-3′
La mezcla de reacción se ejecuta mediante el empleo del estuche para PCR Taq & Go para la amplificación.
Para llevar a cabo la verificación del genotipo las bandas observadas por efecto de la digestión de los productos de PCR por la enzima de restricción, deben evidenciar los siguientes genotipos (Rudholp et al. 1992):
- Normal (homocigoto recesivo, N/N): una banda de 64 pares de bases (pb) y una banda de 28 pb.
- Afectado (heterocigoto, N/H): una banda de 92 pb, una de 64 pb y una de 28 p.b.
- Afectado (homocigoto dominante, H/H): una banda de 92 pb. (Figura 6 del anexo)
Tratamiento.
Los equinos afectados pueden ser tratados con posibilidad de reducir los signos clínicos, pero el grado que ayuda a tratamiento médico varía entre los individuos. No existe una cura.
Algunos, se ven más afectados por la enfermedad que otros y algunos ataques serán más graves que otros, incluso en el mismo individuo.
Para un atraque leve el tratamiento indicado es un poco de ejercicio, ingestión de alimentos ricos en carbohidratos o suplementados con glucosa. Se pueden necesitar diuréticos como la furosemida para detener los ataques. Acetazolamida y diuréticos de tiazida, tales como clorotiazida también son eficaces.
En cambio, el tratamiento para un ataque severo usualmente consiste en la administración intravenosa de reconstituyentes de dextrosa, calcio y sodio. El calcio intravenoso disminuye la actividad de los canales de sodio pudiendo detener los ataques. (Carlos, J., 2015)
La glucosa por vía intravenosa y la insulina estimula la captación de potasio en la célula por la Na-K ATPasa y pueden reducir la debilidad sin una pérdida de potasio corporal total.
Se debe considerar también, la implementación de las buenas prácticas en las explotaciones equinas tales como inocuidad de alimento de los equinos; salud e higiene del personal; calidad del agua de bebida de los equinos; programa para el control de fauna nociva; manejo de excretas y uso apropiado de medicamentos veterinarios (después de realizado el diagnóstico) siendo utilizados de acuerdo a las recomendaciones, dosis, tiempos de retiro y caducidad. (Carlos, J., 2015)
Conclusión y síntesis.
En los pacientes con mutaciones en SCN4A, el canal no es capaz de inactivar, la conductancia de sodio es sostenido y el músculo permanece permanentemente tensa.
Como la placa de extremo del motor es despolarizadas, más señales al contrato no tienen ningún efecto.
La condición es hiperpotasemia debido a una concentración de iones de potasio extracelular alta hará que sea aún más desfavorable para el potasio a salir de la celda con el fin de repolarizarse que el potencial de reposo, y esto aún más prolonga la conductancia de sodio y mantiene el músculo contraído.
Por lo tanto, la gravedad se reduciría si las concentraciones de iones de potasio extracelulares se mantienen bajos.
Ésta mutación no se originó como el producto de endogamia, sino que se empezó a manifestar debido a las cruzas selectivas de buscar animales con mejor musculatura (Moreno, J., 2007).
Además, como la HYPP es una enfermedad de herencia dominante puede transmitirse a otras razas de caballos que utilicen Cuarto de Milla en su conformación genética.
Dada la propagación de la enfermedad en el mundo se vuelve más relevante la identificación del genotipo de los equinos para determinar así cuan intensa puede llegar a ser la afección que se presenta con mayor intensidad a los caballos homocigota dominante (H/H) que los heterocigotas (N/H) y que solamente queda exento de padecerla aquel que posea el gen el homocigota recesivo (N/N).
Anexo

Figura 1: Fotografia del semental Impressive (1969-1995) de raza Cuarto de Milla. Campeón y padre de caballos campeones en conformación.
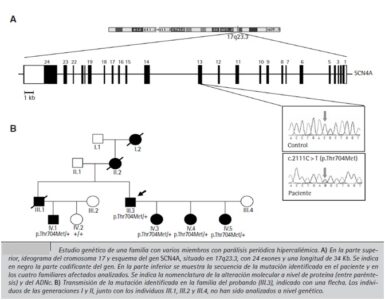
Figura 2: Extraída del artículo Parálisis periódica hipercaliémica: presentación de una familia española con la mutación p.Thr704Met en el gen SCN4A en el cual se muestra el ideograma del cromosoma y un esquema del gen que se presenta de manera similar en los equinos.

Figura 3: Ejemplo de interpretación de resultados del tratamiento de los productos de PCR con la enzima de restricción Taq I. Se muestra los genotipos homocigoto dominante (normal, NN) en el carril 1, heterocigoto (portador, NH) en el carril 2 y homocigoto recesivo (afectado, HH) en el carril 3. Se utilizó el marcador de peso molecular Hiperladder V para verificar el tamaño de los productos de PCR (Moreno Chapa, J. 2007).
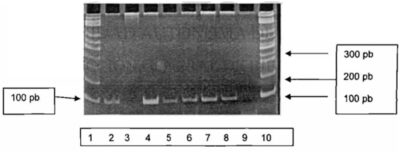
Figura 4. Ejemplo de visualización en el fotodocumentador Fluor- S Multimager*1 (Bio- Rad) de la purificación de ADN a partir de muestras sanguíneas. Carriles 1 y 10: Marcador de peso molecular; carriles 2 a 8: productos de PCR; Carril 9: control negativo. Puede verse que todas las muestras, excepto la del carril 3,(quizá debido a errores de preparación de la mezcla de reacción para PCR siendo ideal que se repitiera el proceso de amplificación) mostraron el producto de PCR esperado de 92 p. b. (Moreno Chapa, J . 2007)

Figura 5: Ejemplo de visualización de análisis RFLP. Puede verse que la Muestra 1 tiene las bandas de 92 y 64 pb., mientras que la muestra 2 solo tiene la banda de 64 pb. La banda de la muestra 3 es un dímero de iniciador. (Moreno Chapa, J., 2007)
Bibliografía
-Ayala, M. (2005) Prevalencia del gen de la Parálisis Periódica Hipercalémica Equina (HYPP) en Avances en la investigación científica en el CUCBA. Jalisco, México. pp 588-591.
– Ayala,-Valldovinos, MA.; Anguiano-Estrella R.; Galindo-García, J.; Sánchez-Chiprés DR.; Duifhuis-Rivera, T. (2002). Prevalencia del gen de la parálisis periódica hipercalémica (hypp) equina y del gen del síndrome overo letal blanco (olws) en caballos importados a México. De /
– Ayala-Valdovinos MA, Villagómez, DAF, Galindo-García J, y Sánchez-Chiprés DR. Diagnóstico molecular (PCR-RFL) de parálisis periódica hipercaliémica equina. XXV Congreso Anual de la Asociación Mexicana de Médicos Veterinarios Especialistas en Equinos, A. C. Octubre 8-11 de 2003:141–144. México.
-Carlos, J. (2015). Alcances del Diagnóstico Veterinario: El uso de técnicas moleculares. Lavet. Retrieved 16 November 2015, de
– Barrett, K., (2010). Ganong Fisiología Médica. Edición 23a. México, D.F.Editorial Mcgraw-Hill. Sección II. pp: 93-114.
-Moreno Chapa, J.,(2007) Determinación alélica de la mutación causante de la parálisis periódica hipercalémica en caballos cuarto de milla y sus cruzas en el noreste de méxico. Tesis de grado de Maestro en Ciencias veterinarias. México, Universidad autónoma de Nuevo León, Facultad de medicina veterinaria y zootecnia.
– Narberhaus, B; Cormand, B.; Cuenca-León, E; Ribasés, M; Monells J. (2008) Parálisis periódica hipercaliémica: presentación de una familia española con la mutación p.Thr704Met en el gen SCN4A. Neurología. 23(7):427-435
-Naylor, J; Niquel, DD; Trimiño, G.; Lightfoot K; Adams, G. (1999) Hyperkalaemic periodic paralysis in homozygous and heterozygous horses: a co-dominant genetic condition en Equine Veterinary. Volumen 31, número 2, Marzo 1999. pp 153-159.
-Pirila R, Lehmus S, Somer H, Baumann P. (2002) Hyperkalemic periodic paralysis. Duodecim.118(14):1475-9.5.
-Rudolph, J; Spier, S; Byrns, G; Rojas, C; Bernoco, D y Hoffman. (1992). Parálisis Periódica en Caballos Cuarto de milla: una mutación en el canal de sodio difundida por la crianza selectiva. Nature Genetics. 2, 144-147.
-Spier, J. (1999) Current facts about Hyperkalemic Periodic Paralysis in horse (hypp) disease.
-Spier, SJ, Carlson, GP, Holliday, TA, et al (1990). La parálisis periódica hipercaliémica en caballos. J Am Vet Med Assoc. 197. Pp 1009-1017.
-Spier SJ. (1993). Current facts about hyperkalemic periodic parálisis (HYPP) disease. The Quarter Horse Journal. April1993. pp 60-63.
–
-Página oficial Universidad de California, Davis: Medicina Veterinaria.
-American quarter horse association
– Hyperkalemic Periodic Paralysis Disease
Parálisis Periódica Hipercalémica (HYPP) en Equinos.
Curso de Genética básica a cargo de Iglesias, Gabriela, año 2015.
Alumna Tscherig Betiana.