Enfermedad poliquística renal en gatos
Enfermedad poliquística renal en gatos
Nuevamente quiero dejarles una monografía realizada por uno de mis alumnos, en este caso Rocío Vega sobre Enfermedad poliquística renal en felinos. Felicitaciones por el trabajo y espero ayude a muchos otros que buscan información sobre el tema
ENFERMEDAD POLIQUITISCA RENAL EN FELINOS
Autora:
Vega I. Rocío. Año: 3°.
Curso: Genética Básica.
Profesor/a: Gabriela M. Iglesias.
Universidad: Universidad Nacional de Rio Negro. Sede Valle Medio.
En la siguiente monografía se tratara la enfermedad renal poliquistica, conocida con las siglas PKD (Polycystic Kidney Disease) también llamado enfermedad poliquistica renal felina, autosómica dominante, que es la enfermedad genética hereditaria más frecuente en gatos persas, exótico cruzas de esta raza.
INTRODUCCION
Afecta principalmente los riñones del gato y aqueja al 37% de la población felina mundial. Consiste en la aparición de pequeños quistes en la corteza renal, que aumentan de tamaño con la edad a medida que se rellena de orina provocando la aparición de insuficiencia renal irreversible, aparece asimismo en el hígado y páncreas ocasionalmente.
Actualmente, la PKD se considera una importante causa de insuficiencia renal que podría afectar a la tercera parte de la población mundial de gatos lo que hace que esta enfermedad sea unas de las de mayor prevalencia dentro de las dolencias hereditarias de los felinos (Ferreira; 2010)
DESARROLLO
Las primeras referencias de la presencia de esta enfermedad en el gato son de hace 30 años pero los estudios específicos no se empezaron a desarrollar hasta 1990.
Actualmente se sabe que es una enfermedad hereditaria y codificada por un gen autosómico dominante. Esto quiere decir que se transmite de padres a hijos a través de los cromosomas no sexuales, no es una enfermedad ligada al sexo (Ya-Jane Lee; 2010).
La ERP se caracteriza por la presencia de quistes de tamaño variable que pueden estar ubicados en la corteza o en la médula renal y ocasionalmente en otros órganos como el hígado, páncreas y bazo.
Presenta un carácter hereditario autosómico dominante y por ello no existe predisposición ligada al sexo. Aunque en el gato los quistes pueden aparecer en animales jóvenes, las manifestaciones clínicas de la enfermedad no aparecen generalmente antes de la edad adulta (Ferreira; 2010).
Es una enfermedad hereditaria de tipo autosómico dominante causada por una mutación puntual del gen PKD1, situado en el cromosoma 18 exón 29 (E3), donde una adenina es sustituida por una citosina en la posición 3284, generándose de esta manera un codón de stop que como consecuencia resulta en la pérdida del 25 % de la proteína C-terminal y que da la formación de una proteína anómala, la policistina, que será la responsable directa de la formación de quistes.
El carácter hereditario autosómico dominante está relacionado con dos tipos de genes. El gen P que representa la forma dominante y el gen p que representa la forma recesiva.
Cada individuo posee dos genes en el locus para ERP: un materno y un paterno. De esta forma, los genes pueden proveer tres combinaciones que son: PP como forma genotípica de homocigota positivo y fenotípica positiva (el animal padece la enfermedad), Pp como forma genotípica de heterocigotas positivos y fenotípica positiva (el animal presenta la enfermedad), y pp como forma genotípica de homocigotas negativo y fenotípica negativa (el animal no padece la enfermedad).
Los animales homocigotas dominantes (PP) que poseen un gen ERP proveniente del padre y otro de la madre no sobreviven, estos animales poseen una forma grave y letal de la enfermedad con muerte antes del nacimiento a una edad temprana, es decir los gatos homocigotas dominantes (PP) mueren en el útero materno.
Los padres genéticamente recesivos y negativos (pp) para ERP no pueden producir en su descendencia gatos positivos, a menos que haya una mutación genética. Por tanto, todos los gatos afectados son heterocigotos (Pp), van a desarrollan la enfermedad entre los 5- 7 años.
De esta manera el cruzamiento de dos gatos negativos, homocigotos recesivos (pp), resulta en gatos sanos.
El cruzamiento de un gato sano (homocigoto recesivo) con un gato afectado (heterocigotoPp) tiene una probabilidad del 50% de que los gatos sean sanos y la otra mitad sean gatos afectados.
El cruzamiento de dos gatos con ERP (heterocigota Pp) puede provocar estadísticamente un 75% de gatos afectados con la enfermedad y el 25% de gatos sanos. Entre los gatos afectados, un tercio serán homocigota-dominantes (Ferreira; 2010).
Gato libre: pp Gato heterocigótica: Pp Gato homocigótica: PP
Gato heterocigota Pp X gato libre pp.
50 % de probabilidad de enfermos.
Gato homocigota PP x gato libre pp.
100 % de enfermos.
Gato heterocigota Pp x gato heterocigota Pp.
75% de probabilidad de enfermos.
Gato homocigota PP x gato homocigota PP.
100% de enfermos.Letal
Gato libre pp x gato libre pp.
100% de libres.
Los gatos con ERP son frecuentemente asintomáticos cuando la afección es unilateral y demuestran signos de insuficiencia renal cuando es bilateral.
En todo caso, los signos clínicos son variables y se asocian al crecimiento de los quistes y a la presión sobre el parénquima renal periférico al quiste que causa daño progresivo de nefronas.
Al ser una enfermedad hereditaria, los quistes están presentes desde el nacimiento del gato, al principio el tamaño del quiste es de menos de 1 milímetro.
A medida que el animal se desarrolla y va cumpliendo años, los quistes empiezan a crecer hasta alcanzar varios centímetros hasta 2 centímetros.
Los signos suelen aparecer entre los tres y los diez años de edad. Se puede observar letargia, anorexia, vómitos, polidipsia, poliuria, pérdida de peso, hematuria, mucosas pálidas, relacionados con la gravedad de la insuficiencia renal crónica.
La hematuria en gatos es probablemente el resultado de hemorragias intrarenales y es similar al que sucede en humanos. A la palpación los riñones estarán alargados e irregulares. (Ferreira; 2010).
Diagnostico
Entre las herramientas para el diagnóstico de la ERP en los gatos se incluyen la anamnesis, el examen clínico, los análisis de sangre y orina, las pruebas genéticas, la ultrasonografía renal, la tomografía computarizada, la urografía excretora y el estudio histológico de biopsias renales. La biopsia renal está contraindicada en presencia de quistes grandes.
Pruebas genéticas
Es posible identificar la mutación asociada a la ERP mediante la prueba de la reacción en cadena de la polimerasa (PCR) combinado con un estudio del polimorfismo de longitud de los fragmentos de restricción (RFLP). Estos métodos necesitan de una gran cantidad de ADN y de buena calidad. El presente estudio para la identificación del PKD1 se puede desarrollar en una veterinaria que disponga del equipo necesario fácilmente. (Ferreira; 2010).
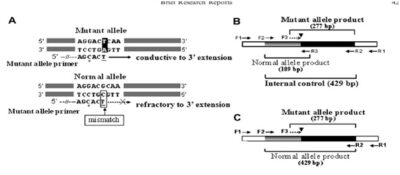
Para el genotipeo del exón 29 del gen PKD1 por ARMS (amplification refractory mutant system) PCR, se designan dos set de primers para rotular ya sea el alelo mutante o el normal, basado en el punto de mutación de Citosina- Adenina.
La amplificación de los dos alelos (alelo-especifico) toma lugar en direcciones opuestas y los fragmentos de ADN de diferentes longitudes pueden ser fácilmente visualizados en gel agarosa por electroforesis (fig n°2).
La discriminación de la amplificación depende principalmente de la falta de coincidencia de nucleótidos en el primer 3´-terminacion.
El primer alelo- especifico del proceso del PCR solo permitirá que la amplificación se pueda hacer cuando el 3´- nucleótido terminal concuerde con su secuencia diana. Además se agregó deliberadamente un desajuste adicional en la cuarta parte del último nucleótido, en la posición final del 3´primer para incrementar el rango de discriminación(Fig n°1). (Ya-Jane Lee; 2010).

Fig n° 2. (Ya-Jane Lee; Journey of Veterinary Diagnostic Investigation; 2010)
Procedimiento de Prueba
Como se muestra en la figura 2 el primer específicos del alelo mutante F3 y R2 amplificó un fragmento de 277 pb sólo de la muestra mutante, mientras que el fragmento de ADN con un tamaño esperado de 189 pb fue amplificado a partir del alelo de tipo salvaje por los cebadores F2 y R3.
Como era de esperar, el producto de PCR correspondiente a el alelo normal también se obtuvo de la muestra de ADN que contenía el punto mutante PKD1 porque los gatos con PQRAD son heterocigóticos en el locus de este gen.
Estos resultados confirmaron la especificidad de estos set de primers para diferenciar el alelo PKD1 normal del alelo PKD1 mutante que contenía un solo punto de mutación.
A continuación, para simplificar el procedimiento de manejo, para posibilitar la amplificación simultánea del alelo mutante y normal los productos específicos en 1 tubo se puso a prueba. Cuatro primers: 1 ml de F2, F3, R2, y R3 (10 mM) se incluyeron en 1 reacción (ARMS-tetra primers de PCR) para investigar si porciones de los dos alelos diferentes de PKD1 podrían ser diferencialmente amplificada.
Tres productos que representan la amplificación del alelo mutante (227 pb), de la normal alelo (189 pb), y un control interno (429 pb) se esperó que fuesen amplificados en los experimentos (Fig 1b).
Como se muestra en la figura 2 barra 5 solo dos productos de PCR de429 pb y 277 pb fueron amplificados por el set de primers externos F2 / R2 y el primer par-alelo mutante F3 / R2.
La ausencia del producto 189-bp indicó que el primer normal alelo fallo al ser amplificado.
Se hicieron intentos para optimizar la ARMS tetra-primer reacción de PCR, por ejemplo, el ajuste de la temperatura de recocido (68-72°C) y usando diversas concentraciones de primers individuales y de MgCl2(1-5 mM); sin embargo, no se obtuvieron resultados satisfactorios.
En consecuencia, un ARMS tri-PCR primers fue desarrollado para superar el problema como se describe a continuación. Según lo informado por otros grupos de investigación, los gatos que se ponen a prueba y dan positivo para el alelo mutante son heterocigotas y, por lo tanto, también tienen un alelo de tipo salvaje.
Debido a que tanto gatos normales como afectados PQRAD contienen alelo normal, la detección de la presencia de 1 alelo normal no es crítico para diagnóstico de la PQRAD, siempre y cuando el control interno que rotula otra región del gen de PKD se amplifique con éxito para asegurar que el PCR era funcional.
Esto condujo a el desarrollo de una prueba de ARMS PCR que utiliza sólo 3 cebadores (ARMS-triprimers de PCR) y que omite el primer alelo normal- R3 (Fig. 1C). (Ya-Jane Lee; 2010)
Se señaló que la prueba genética de PCR-RFLP fue más sensible que la ultrasonografía para detectar la ERP en gatos persas de menos de tres meses de edad.
Los gatos persas y afines a gatos persas deben ser probados para ADPKD (autosomal dominant polycystic kidney disease) antes de la cruza.
Incluso cuando los criadores de gatos saben que nunca deben cruzarse animales que posean el gen mutante PKD1, esto sigue ocurriendo por varias razones:
Los animales portadores no expresan signos clínicos de ADPKD en la vida temprana.
Muchos criadores todavía no son conscientes de la enfermedad y su impacto.
La ecografía no está disponible o su costo es muy elevado.
La cruza se realiza previo a un diagnóstico preciso.
La enfermedad tiene una alta prevalencia, por lo tanto, muchos criaderos podrían perder aproximadamente el 40 % de su población reproductora.
Las pruebas genéticas para ADPKD proporcionan un método preciso y eficiente de la selección de los gatos de cría, y así podría funcionar para eliminar ADPKD del programa de cría (Marcela C. Scalon; 2014).
Tratamiento
Las opciones de tratamiento están muy limitadas y son de muy mal pronóstico, se debe tratar como un riñón terminal y esto incluye rehidratación y estabilización del paciente, restricción en la dieta de proteínas para evitar la alta producción de metabolitos nitrogenados, disminuir los niveles de urea en el organismo, restricción de fósforo en la alimentación, y suplementación dietética en cuanto sea posible con vitaminas, taurina, potasio, sodio, bicarbonato.
Es recomendable proveer al paciente de agua fresca ad libitum. Se debe evitar en lo posible el estrés a estos gatos.
El trasplante renal es una opción si se dispone de donante y de la infraestructura necesaria para hacerlo aunque, por regla general, no está a nuestro alcance para gatos con insuficiencia renal crónica por enfermedad renal poliquística (Lorena Millán Varela).
CONCLUSIÓN
A modo de conclusión se puede decir que esta enfermedad de carácter dominante autosómico que afecta principalmente a los gatos persas y a los felinos producto de la cruza con esta raza, es uno de los mayores problemas para los criadores y propietarios debido al carácter crónico de la enfermedad.
Afecta principalmente la funcionalidad del riñón, pero también puede llegar a afectar el páncreas e hígado apareciendo en animales de edad avanzada pero que está presente en el felino desde el momento de su nacimiento.
La detección de la enfermedad es simple siendo la ecografía, o exámenes genéticos como el PCR los más comunes y usados.
En caso de que el animal de positivo a la enfermedad poliquística renal se deberá proceder a la esterilización de este y realizar el tratamiento adecuado para garantizarle una buena calidad de vida dentro de las posibilidades de este.
BIBLIOGRAFIA
Ferreira, G.S; Anales de veterinaria de Murcia; 2010. Enfermedad renal poliquística en gatos: Revisión de la literatura. Vol 26. ().
Ya-Jane Lee; Journey of Veterinary Diagnostic Investigation; 2010. Molecular Detection of Autosomal-Dominant Feline Polycystic Kidney Disease by Multiplex Amplification Refractory Mutation System Polymerase Chain Reaction.
Lorena Millán Varela; Facultad de Veterinaria. Universidad de León; Importancia de la Enfermedad Renal Poliquística en el gato Persa.
Marcela C. Scalon ; Journal of veterinary diagnostic investigation; 2014; Touchdown polymerase chain reaction detection of polycystic kidney disease and laboratory findings in different cat population